Biologiczne wsparcie dla stawów – Nowa odsłona!
Kontuzje są nieprzyjemnym doświadczeniem u każdego sportowca. Niestety, sport wytrzymałościowy nierozerwalnie związany jest z kontuzjami przeciążeniowymi. Do urazów dochodzi z różnych powodów. Są to błędy treningowe, nadmierne obciążenia, brak właściwej regeneracji czy zaburzenia biomechaniczne naszego ciała. Dużej części kontuzji można zapobiec, ale czynnikiem ryzyka, na który nie mamy wpływu jest wiek. Im jesteśmy starsi tym ryzyko zaistnienia kontuzji wzrasta.
Nasz narząd ruchu podlega procesowi zużywania związanemu z wiekiem i jakkolwiek by nie zaklinać rzeczywistości, nie możemy tego procesu zatrzymać. U biegaczy dominują kontuzje kończyny dolnej i często dotyczą kolana. Wielu moich pacjentów bagatelizuje pojawiające się problemy twierdząc, że to „jedynie” uszkodzenie łąkotki czy chonodromalacja chrząstki, nie mniej są to objawy szerszego problemu jakim jest choroba zwyrodnieniowa stawu.
Wielu z Was na dźwięk określenia „choroba zwyrodnieniowa” wyobraża sobie osoby starsze, niedołężne, często posługujące się kulami łokciowymi. Tu chciałbym wszystkich Was uspokoić. Proces zużywania stawu ma bardzo szerokie spektrum, w którym obraz starszej, niepełnosprawnej osoby jest stadium krańcowym. Gdzieś na zupełnym początku są problemy z niewielkimi uszkodzeniami chrząstki (chondromalacja), czy uszkodzeniami łąkotki (Ratujmy łąkotkę). Niemniej jednak, pierwsze objawy trzeba potraktować jako sygnały procesu, który ma zawsze charakter postępujący i przebiega w bardzo indywidualnej dynamice. Wobec choroby zwyrodnieniowej stawów nie pozostajemy bezbronni, odnosimy spore sukcesy w staraniach o zachowanie komfortu życia codziennego i zachowanie możliwości uprawiania sportu.
Coraz większy problem
Choroba zwyrodnieniowa jest najczęstszą chorobą narządu ruchu i najczęstszą chorobą stawów. Ze względu na wzrastającą liczbę pacjentów, choroba zwyrodnieniowa staje się poważnym problemem w systemach opieki medycznej (1,2). Aczkolwiek wśród pacjentów dominują osoby z nadwagą i nieaktywne fizyczne, to również z problemem tym zmagają się szczupłe, wysportowane i aktywne osoby. Wiąże się to z faktem występowania czynników ryzyka niezależnych od pacjenta, to znaczy genetycznej predyspozycji oraz faktu, że wieloletni i intensywny trening biegowy wpływa na stan stawów obciążanych (stawu kolanowego i biodrowego) (3,4,5).
Stan zapalny jest przyczyną degradacji stawu
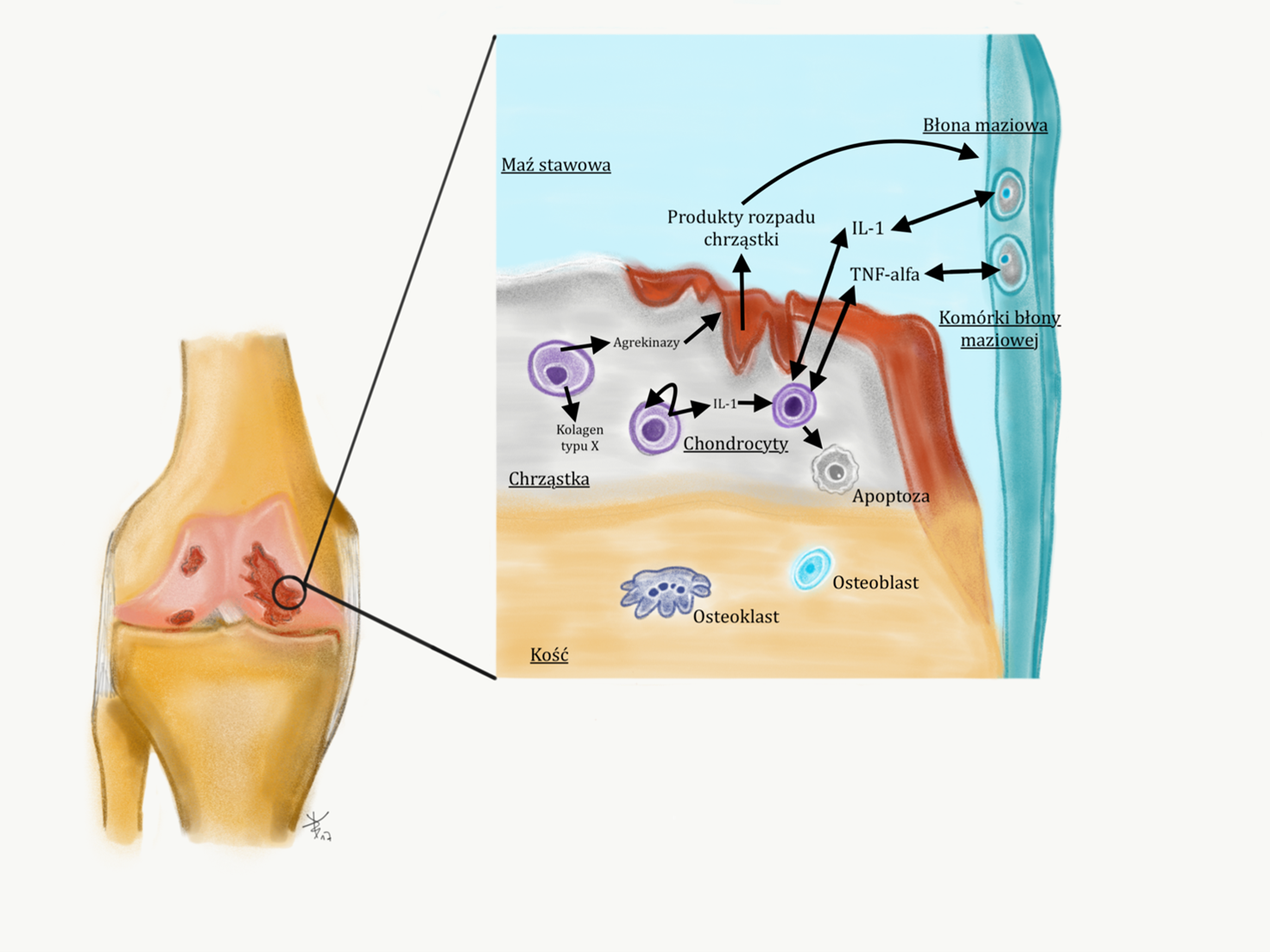
W chorobie zwyrodnieniowej stawów, proces, który prowadzi do powolnego i stopniowego niszczenia wszystkich elementów stawu (chrząstki, łakotek, więzadeł, warstwy podchrzęstnej kości, błony maziowej) to proces zapalny o nieustalonej etiologii (6). Proces zapalny toczy się na poziomie komórkowym i prowadzi do degeneracji białek macierzy chrząstki stawowej (kolagen, proteoglikany), przyczyniając się do rozmiękania chrząstki i jej niszczenia (chondromalacja). Bezpośrednio odpowiedzialne są za to niszczące enzymy proteolityczne, tak zwane metaloproteinazy (ang matrix metalloproteinases, MMP). Są one produkowane przez komórki chrząstki – chondrocyty. Obecnie znanych jest ponad 20 enzymów z tej grupy. W normalnych, fizjologicznych warunkach, enzymy MMP są unieszkodliwiane (- czynione nieczynnymi) przez inhibitory metaloproteinaz (ang. tissue inhibitors of metalalloproteinasses, TIMP).
W zdrowym stawie istnieje równowaga pomiędzy enzymami niszczącymi chrząstkę MMP, a enzymami chroniącymi chrząstkę TIMP. Gwarantuje to utrzymanie stałej grubości chrząstki stawowej i stwarza warunki do jej przebudowy (z ang. remodelingu) w procesie, który dostosowuje chrząstkę do zmieniających się warunków mechanicznych.
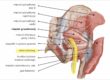
W chorobie zwyrodnieniowej dochodzi do zachwiania równowagi na korzyść enzymów niszczących MMP, co prowadzi do ścieńczenia chrząstki i szeregu niekorzystnych zmian w stawie. Poznanie i zrozumienie kaskady reakcji zapalnej na poziomie molekularnym daje nadzieje na zahamowanie niszczenia stawu. Rysunek 1.
W procesie zapalnym dochodzi do produkcji mediatorów reakcji zapalnej (biochemicznych przekaźników), takich jak czynnik martwicy nowotworów TNF alfa, interleukina-1, insulinopodobny czynnik wzrostu IGF, a także tlenek azotu NO.
To te czynniki stymulują chondrocyty do produkcji enzymów niszczących, czyli enzymów MMP. Celowo wprowadzam Czytelnika w zawiłości biochemiczne procesu zwyrodnieniowego, gdyż nowoczesne terapie działają właśnie poprzez biologiczne ograniczenie aktywności niszczących chrząstkę enzymów. Wyjaśnienie pochodzenia procesu pozwoli zrozumieć korzyść terapii.
Najnowsze rekomendacje
W roku 2019, Europejskie Towarzystwo Klinicznych i Ekonomicznych Aspektów Osteoporozy i Osteoartrozy (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis, ESCEO) opublikowało algorytm postępowania (7). Nadrzędną zasadą jest rozpoczęcie terapii od postępowania niefarmakologicznego.
Osobiście uważam tę drogę postępowania za bardzo istotną i determinująca powodzenie.
Obejmuje ona:
- Edukacja pacjenta na temat specyfiki problemu
- Zmiana stylu życia, redukcja masy ciała, zdrowa dieta
- Ćwiczenia ruch, gimnastyka, rozciąganie
Uważam, że przekonanie pacjenta do zmiany, a więc redukcji czynników ryzyka postępu choroby zależnych od niego, jest bardzo ważnym elementem i silnym argumentem w poprawie jakości życia. Pacjent musi wiedzieć, że jego postawa ma wpływ na chorobę, a swoim działaniem może poprawić swoją sytuację. Niejednokrotnie można tą drogą osiągnąć najwięcej i ten element terapii determinuje sukces dalszego leczenia.
Narastający problem zużywania stawów motywował naukowców do poszukiwania coraz nowocześniejszych terapii. W oparciu o aspekt zapalnego charakteru procesu, pracowano nad biologicznymi rozwiązaniami. I tak, w latach 90-tych rozpoczęto badania nad stosowaniem kwasu hialuronowego podawanego bezpośrednio do stawu (wiskosuplementacja) (8). Zdjęcie 1.
Kwas hialuronowy jest związkiem organicznym, polisacharydem, obecnym w tkance łącznej, w tym również w chrząstce. Bierze udział w budowie macierzy pozakomórkowej chrząstki i ma właściwość wiązania cząsteczek wody, czym nadaje chrząstce szklistej elastyczność i sprężystość. W procesie niszczenia chrząstki zmniejsza się jego ilość w tkance. Sam kwas hialuronowy posiada specyficzne właściwości biofizyczne, biochemiczne oraz bioregulujące. Większość pacjentów porównuje efekt podania kwasu hialuronowego do stawu z „podaniem smaru”. Jest w tym trochę prawdy, gdyż dzięki jego właściwościom biofizycznym (wiskoelastyczność) ułatwia on toczenie (przesuwanie się) powierzchni stawowej między sobą. To przekonanie jest wzmocnione faktem, że po jego zastosowaniu znikają wcześniej odczuwalne przeskakiwania i trzeszczenia w stawie. Jednakże kwas hialuronowy ma także działanie biologiczne, poprzez modulacje procesu zapalnego, który niszczy staw. Hamuje on działanie niszczących enzymów metaloproteinaz MMP.
Tabela 1. Mechanizmy działania kwasu hialuronowego
| Efekty podania kwasu hialuronowego do stawu |
| działanie przeciwbólowe, poprzez hamowanie receptorów nocyceptywnych w stawie, odpowiedzialnych za przewodzenie bólu |
| stymulacja chondrocytów do produkcji endogennego, to znaczy własnego kwasu przez staw |
| stymulacja wzrostu chondrocytów |
| działanie przeciwzapalne, hamowanie enzymów (metaloproteinazy) odpowiedzialnych za niszczenie chrząstki w chorobie zwyrodnieniowej |
| poprawa właściwości wiskoelastycznych mazi stawowej, to znaczy poprawa toczenia i ślizgania się powierzchni chrzęstnej, czyli przysłowiowo „smarowanie” stawu |
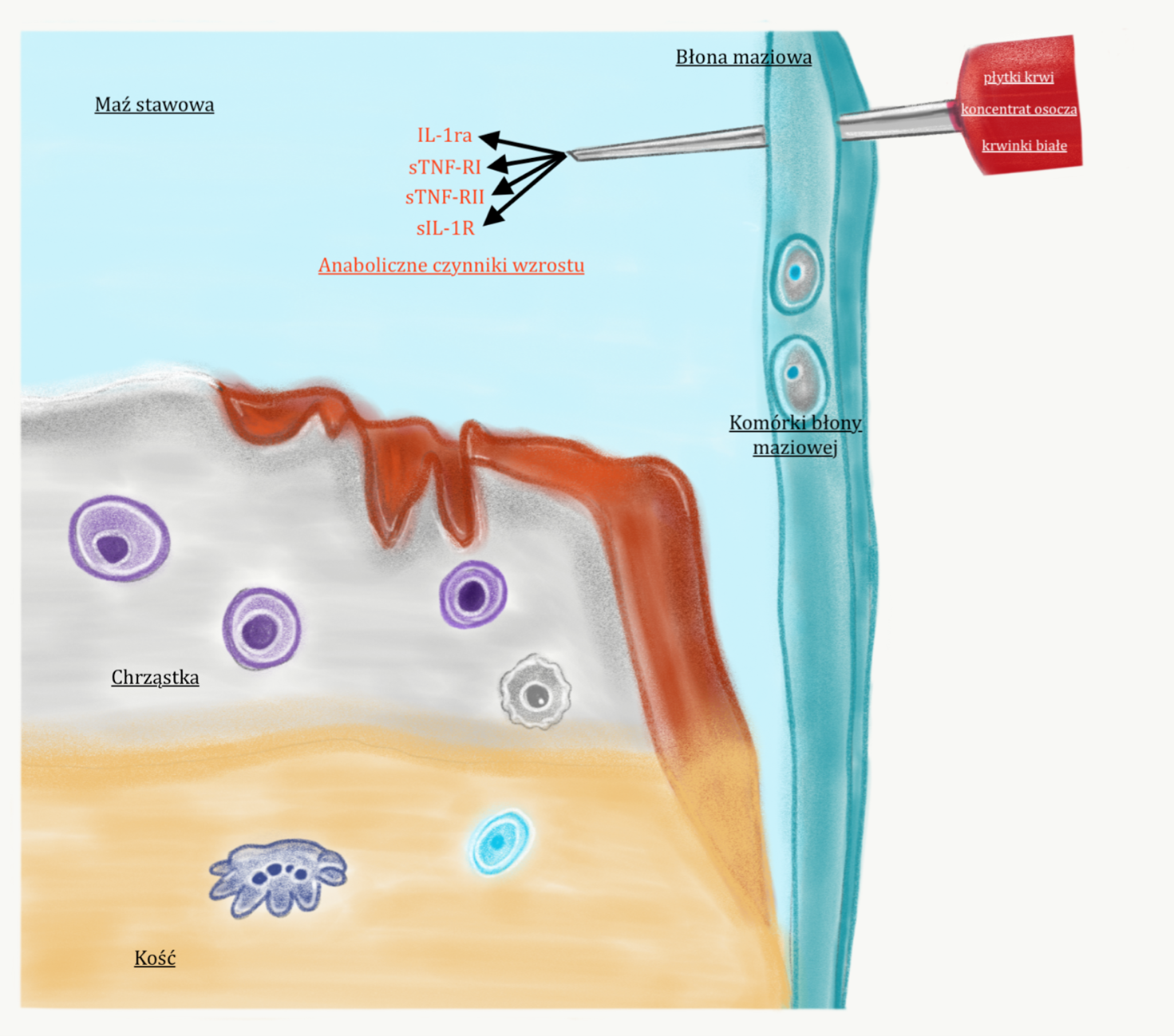
Niestety działanie biologiczne kwasu związane z hamowaniem procesu zapalnego, nie jest tak silne jakbyśmy tego oczekiwali. Stąd też, z początkiem XXI wieku, zaczęto poświęcać wiele uwagi na zastosowanie wyselekcjonowanych komórek, które wspomogłyby hamowanie procesu zapalnego leżącego u podstawy niszczenia stawu. Zainteresowano się komórkami macierzystymi (mesenchymal stem cells MSCs), które mają największy biologiczny potencjał do naprawy uszkodzeń. Jednakże ich pozyskanie jest trudne, gdyż znajdują się one w szpiku kostnym i tkance tłuszczowej. Z tego powodu, poświęcono więcej uwagi komórkom, które łatwo pobrać z krwi żylnej, to znaczy do płytkom krwi (9).
Płytki krwi aktywnie uczestniczą w modulacji procesu zapalnego, są źródłem mediatorów-cytokin, które hamują destrukcyjny proces zapalny oraz stymulują gojenie (10). Potocznie nazywane są też czynnikami wzrostu. Należą do nich:
– FGF czynnik wzrostu fibroblastów
– PDGF płytkopochodny czynnik wzrostu
– TGF beta transformujący czynnik wzrostu
– VEGF Czynnik wzrostu śródbłonka naczyniowego
Płytki krwi pozyskuje się poprzez poddanie krwi żylnej pacjenta specjalnej obróbce (odwirowanie i selekcjonowanie). Dzięki temu uzyskuje się osocze z dużą koncentracją płytek krwi (osocze bogatokomórkowe). Zastosowanie osocza bogatokomórkowego (platelet rich plasma PRP) pozwala na ograniczeniu procesu zapalnego na poziomie komórkowym, aktywując również pewne procesу naprawcze i regeneracyjne. Niestety, medycyna nie znalazła sposobu by móc zregenerować chrząstkę szklistą do stanu sprzed uszkodzenia, dlatego hamowanie degradacji chrząstki w chwili obecnej jest głównym celem terapii. Jak pisałem wcześniej, w stawie odbywa się „starcie” pomiędzy metaloproteinazami niszczącymi staw, a jej inhibitorami. My w tej walce, poprzez zastosowanie PRP dostarczamy biologicznych argumentów, by hamować działanie niszczących enzymów w stawie. Rysunek 2.
Do niedawna byliśmy w posiadaniu dwóch biologicznych metod terapii choroby zwyrodnieniowej: kwasu hialuronowego i osocza bogatopłytkowego PRP – dwóch metod o trochę różnych mechanizmach działania.
Wobec tego, racjonalnym wydawało się, by te dwie różne metody połączyć w jedną i przy pomocy jednej iniekcji dostarczyć do stawu nie tylko pakiet czynników wzrostu, lecz również substancje poprawiające właściwości wiskoelastyczne płynu stawowego.
Innymi słowy, połączyć korzyści wynikające z tych dwóch metod w jedną.
I takie założenie okazało się prawdziwe, a badania naukowe potwierdziły jego słuszność (11,12).
Zastosowanie kombinacji kwasu hialuronowego wraz z osoczem bogatopłytkowym, zwiększa efekt działania przeciwbólowego, poprawia sprawność i jakość życia w porównaniu do zastosowania jedynie samego kwasu hialuronowego. Co więcej, badanie z wykorzystaniem rezonansu magnetycznego po podaniu kwasu hialuronowego i PRP wykazały zmniejszenie objawów zapalnych stawu typowych dla choroby zwyrodnieniowej (13). Obecnie dostępne są gotowe zestawy, zawierające kwas hialuronowy wraz odczynnikami do separacji płytek (cellular matrix). Odwirowanie próbówki pozwala uzyskać roztwór kwasu hialuronowego z osoczem bogatoplytkowym, gotowym do iniekcji (14). W prosty sposób można połączyć dwie metody biologicznego wsparcia stawu, uzyskując lepszy efekt terapeutyczny. W przypadkach bardziej zaawansowanych zabieg należy powtórzyć, wzmacniając efekt.
Osoby aktywne sportowo, w tym biegacze, to wymagająca grupa pacjentów.
Nie akceptują zaleceń w charakterze „koniec z bieganiem” i w pełni ich rozumiem. Z drugiej strony, są to osoby prowadzące zdrowy styl życia, zwracające uwagę na dietę, wysportowane. Kwestie związane z niefarmakologicznym postępowaniem, to znaczy modyfikacją stylu życia, nie mają zbytnio zastosowania, gdyż osoby te już taki tryb życia prowadzą. Wobec tego, użycie” biologicznych” metod dla wspomagania regeneracji stawu należy rozważyć już na wstępie leczenia. Połączenia dwóch synergistycznych metod w jedną, jest w mej ocenie bardzo dobrym rozwiązaniem pozwalającym zahamować proces zapalny i nadal być aktywnym. A z moich obserwacji, że metoda ta przynosi bardzo dobre efekty.
Powodzenia!
Biegający Ortopeda
Bibliografia
- Sharma, Leena, Dipali Kapoor, and Sakeba Issa. „Epidemiology of osteoarthritis: an update.” Current opinion in rheumatology 18.2 (2006): 147-156.
- Cross, Marita, et al. „The global burden of hip and knee osteoarthritis: estimates from the global burden of disease 2010 study.” Annals of the rheumatic diseases 73.7 (2014): 1323-1330.
- Spector, Tim D., et al. „Risk of osteoarthritis associated with long‐term weight‐bearing sports: a radiologic survey of the hips and knees in female ex‐athletes and population controls.” Arthritis & Rheumatism: Official Journal of the American College of Rheumatology 39.6 (1996): 988-995.
- Cheng, Yiling, et al. „Physical activity and self-reported, physician-diagnosed osteoarthritis: is physical activity a risk factor?.” Journal of clinical epidemiology 53.3 (2000): 315-322.
- Kujala, Urho M., Jaakko Kaprio, and S. Sarno. „Osteoarthritis of weight bearing joints of lower limbs in former elite male athletes.” Bmj 308.6923 (1994): 231-234.
- Hunter, D. J. „The epidemiology of osteoarthritis.” Best Pract res clin rheumatol 28 (2014): 5-15.
- Bruyère, Olivier, et al. „An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO).” Seminars in arthritis and rheumatism. Vol. 49. No. 3. WB Saunders, 2019.
- Balazs, Endre A., and J. L_ Denlinger. „Viscosupplementation: a new concept in the treatment of osteoarthritis.” The Journal of rheumatology. Supplement 39 (1993): 3-9.
- Barry, Frank, and Mary Murphy. „Mesenchymal stem cells in joint disease and repair.” Nature Reviews Rheumatology 9.10 (2013): 584-594.
- Marx, Robert E. „Platelet-rich plasma: evidence to support its use.” Journal of oral and maxillofacial surgery 62.4 (2004): 489-496.
- Adam, Philippe, Jean Luc Renevier, and Jean-Francois Marc. „A novel treatment of knee degenerative disorders all-in-one intra-articular injection of platelet-rich plasma combined with hyaluronic acid.” International Journal of Clinical Rheumatology (2018): 280.
- Renevier, Jean-Luc, et al. „“Cellular matrix™ PRP-HA”: A new treatment option with platelet-rich plasma and hyaluronic acid for patients with osteoarthritis having had an unsatisfactory clinical response to hyaluronic acid alone: Results of a pilot, multicenter French study with long-term follow-up.” International Journal of Clinical Rheumatology 13.4 (2018): 230.
- Marc, Jean-François, and Jean-Luc Renevier. „High-field MRI exploration of the structural effects of cellular matrix™ on articular cartilage in knee osteoarthritis: A pilot study in 6 patients.” International Journal of Clinical Rheumatology 13.5 (2018): 296.
- https://www.regenlab.com/corporate/musculoskeletal/cellular-matrix-ortho/