Chonodromalacja – co, jeżeli pojawi się w twojej diagnozie?
Powracam z tematem chrząstki stawowej.
Informacja o uszkodzeniu chrząstki deprymuje pacjenta, a w szczególności sportowca. Jest on jednak pełen wiary w możliwość medycyny i leczenia. Niestety sprawa jest bardzo złożona… Nieleczone uszkodzenia chrząstki prowadzą do zniszczenia stawu, a w konsekwencji do ograniczenia jego funkcji i ograniczenia ruchomości.
Jest to bezpośrednią przyczyną ograniczenia możliwości sportowych. W zaawansowanych przypadkach utrudniających również codzienne życie.
Problem uszkodzenia chrząstki jest szczególnie uciążliwy w stawach obciążanych, takich jak staw biodrowy, kolanowy czy skokowy.
W fachowym nazewnictwie, uszkodzenia chrząstki określa się słowem chondromalacja. Pisałem już o tym w tekście https://biegajacyortopeda.pl/porady-ortopedy/chondromalacja-czesty-problem/.
Jaka jest funkcja chrząstki?
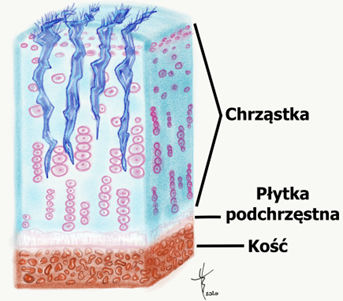
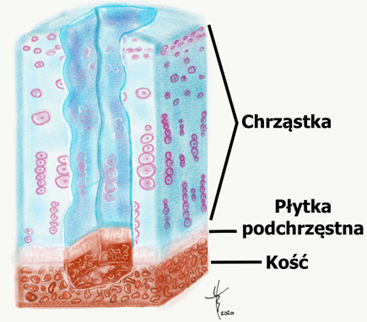
Chrząstka szklista pokrywa końce stawowe kości i tym samy jest głównym elementem stawu. Jest gładka i połyskliwa, dzięki czemu ma bardzo niski współczynnik tarcia. Dzięki temu ruch toczenia i poślizgu w stawie odbywa się bardzo gładko i łatwo. Ale chrząstka szklista ma również inne cechy: twardość i sprężystość. To czynni ją odporną na obciążenie. U dzieci, chrząstka szklista występuje jeszcze w chrząstce nasadowej kości i odpowiada za wzrost kości. Po zakończeniu wzrostu, u dorosłego człowieka, chrząstka szklista występuje poza stawami, w krtani, tchawicy, dużych oskrzelach oraz żebrach.
Chrząstka to jeden z rodzajów tkanki łącznej. Wprawdzie słowo chrząstka kojarzy się większości ze budową stawu, to chrząstka występuje również w innych miejscach naszego ciała. Wyróżniamy 3 typy chrząstki
- Chrząstka szklista – posiada gładką, twardą, lśniącą powierzchnię i pokrywa końce kości formującej staw. Występuje również w krtani, tchawicy, a także w części żeber
- Chrząstka włóknista – tworzy ścięgna i więzadła, krążki międzykręgowe (dyski), łąkotki w kolanie. Składa się głównie z kolagenu, ale innego typu niż tkanka szklista, dzięki czemu jest bardziej elastyczna.
- Chrząstka sprężysta – jest bardzo elastyczna,. Zbudowane są z niej małżowiny uszne, części nosa i krtani
Budowa chrząstki szklistej
Chrząstka stawowa składa się przede wszystkim z wody, która stanowi około 75% jej ogólnej masy. Pozostała część chrząstki to kolagen (z czego 90% to kolagen typu II), proteoglikany, białka niekolagenowe i komórki (chondrocyty). Chondrocyty, które wytwarzają kolagen, proteoglikany i enzymy. Skład chrząstki stawowej, a w szczególności wysoka zawartość wody i organizacja struktury, pozwala spełniać jej funkcje zmniejszania tarcia i równomiernego rozkładajnia naprężeń, jakim poddawane są stawy.
Jednakże te cechy budowy chrząstki szklistej (stawowej) wnoszą też swoje ograniczenia. Ze względu na słabe unaczynienie (brak naczyń krwionośnych) chrząstka ma bardzo mały potencjał gojenia a leczenie uszkodzeń chrząstki stawowej jest szczególnie trudne1.
Odżywianie chrząstki nie odbywa się poprzez naczynia krwionośne, ale poprzez płyn stawowy. Powierzchowne uszkodzenia chrząstki zazwyczaj nie prowadzą do prawdziwego „gojenia”, ponieważ dojrzałe chondrocyty (komórki chrząstki stawowej) mają ograniczone możliwości proliferacyjne, a tym samym możliwości naprawy. Tak więc, by uszkodzenie chrząstki mogło pokryć się blizną, musi być głębokie i dosięgać warstwy podchrzęstnej kości, która jest już unaczyniona. Dzięki temu, na podłożu krwiaka i komórek mesenchymalnych (multipotencjalnych) możliwe jest pokrycie uszkodzonej chrząstki blizną. Jednakże, powstała blizna w istocie nie jest tą samą tkanką, co chrząstka szklista. Przypominając wyglądem chrząstkę stawową jest w istocie chrząstką włóknistą, o innych już właściwościach.
Odporność chrząstki na obciążania i uszkodzenia
Budowa chrząstki szklistej umożliwia jej przenoszenie i amortyzowanie obciążeń, jakim poddawane jest nasze ciało. Co więcej, ruch i aktywność sportowa – w tym bieganie – poprzez cykliczne obciążanie, w sposób fizjologiczny stymuluje produkcję macierzy pozakomórkowej chrząstki, przyczyniając się do jej przebudowy2,3 . Dlatego też, w przypadku problemów z chrząstką, tak jak w początkowych etapach choroby zwyrodnieniowej, nie należy rezygnować z gimnastyki, ćwiczeń i ruchu.
Niestety, gdy obciążęnie są nadmierne i przekraczające fizjologiczne możliwości adaptacyjne chrząstki, może dochodzi do degradacji macierzy i tym samym niszczenia chrząstki.
Generalnie możemy wyróżnić uszkodzenia chrząstki występujące w wyniku jednorazowego urazu, np. skręcenia kolana, zwichnięcia rzepki lub wielu, powtarzających się w czasie nadmiernych obciążeń. Spektrum uszkodzeń chrząstki jest bardzo szerokie – od ubytków ogniskowych po bardziej przewlekłe, rozlane uszkodzenia.
Objawy uszkodzeń chrząstki
W przypadku urazowych uszkodzeń – np. skręcenia kolana – sytuacja jest klarowna. Takiej sytuacji towarzyszy krwiak, obrzęk stawu, brak możliwości obciążenia kończyny i poruszania nią.
W przypadku uszkodzeń przeciążeniowych (zwyrodnieniowych) chrząstki objawem dominującym jest ból. Pojawia się on po dłuższym i intensywniejszym wysiłku, a może towarzyszyć mu wysięk (obrzęk) w stawie, uczucie przeskakiwania oraz tarcia podczas ruchu.
Uszkodzenie chrząstki stawowej jest dominującym elementem choroby zwyrodnieniowej stawów. Objawy choroby mogą być bardzo różnorodne, w zależności od jej stopnia zaawansowania https://biegajacyortopeda.pl/porady-ortopedy/dlaczego-dochodzi-do-chzs/. W przypadkach niewielkich zmian choroba może manifestować się okresowym bólem stawu po większym wysiłku. W przypadku zmian zaawansowanych, ból i trudności z poruszaniem towarzyszą pacjentowi w życiu codziennym.
Dlaczego dochodzi do uszkodzeń chrząstki?
Najczęstsze przyczyny uszkodzeń przeciążeniowych powiązane są z:
1.Nadmiernymi obciążeniami: nadmierna waga, praca stojąca, sport wyczynowy
2.Zaburzeniami osi kończyny: szpotawość, koślawość kolan, nadmierna pronacja stóp-płaskostopie
3.Niestabilnośc stawu, powtarzające się epizody skręceń stawu np. w przypadku uszkodzenia więzadła krzyżowego przedniego kolana
4.Przebytymi chorobami rozwojowymi stawów np. dysplazja stawu biodrowego, martwica aseptyczna
5.Chorobami zapalnymi stawów np. reumatyczne zapalanie stawów
6.Najczęstsza przyczyna uszkodzeń jest jednak nieznana (tzn. idiopatyczna). Choroba zwyrodnieniowa czyściej dotyka kobiet i jest często związana z rodzinnym występowaniem.
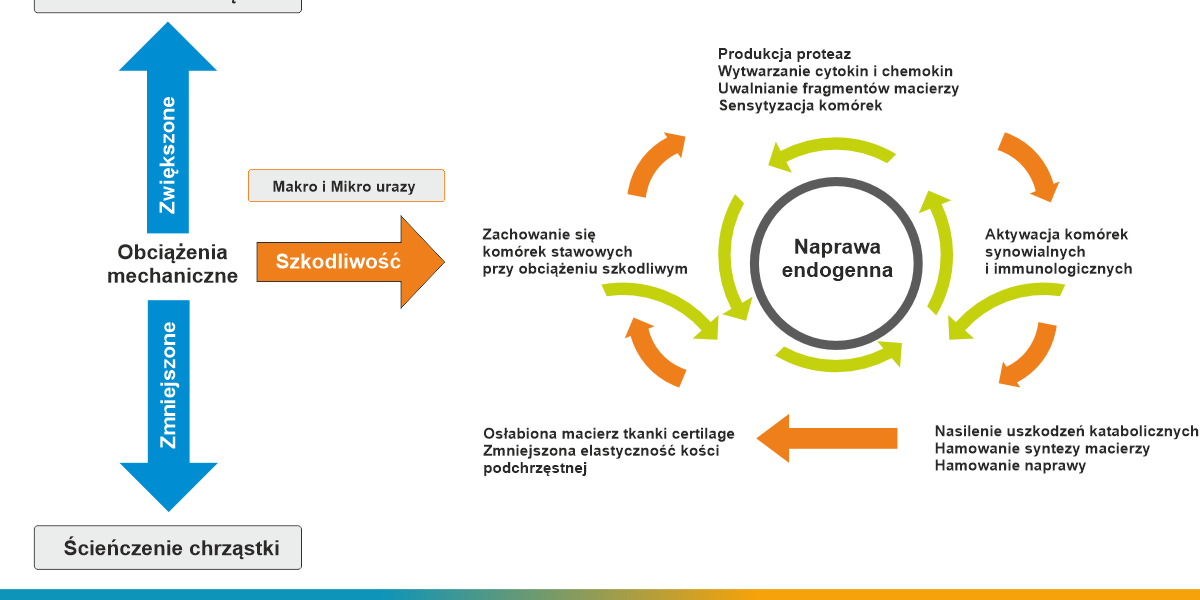
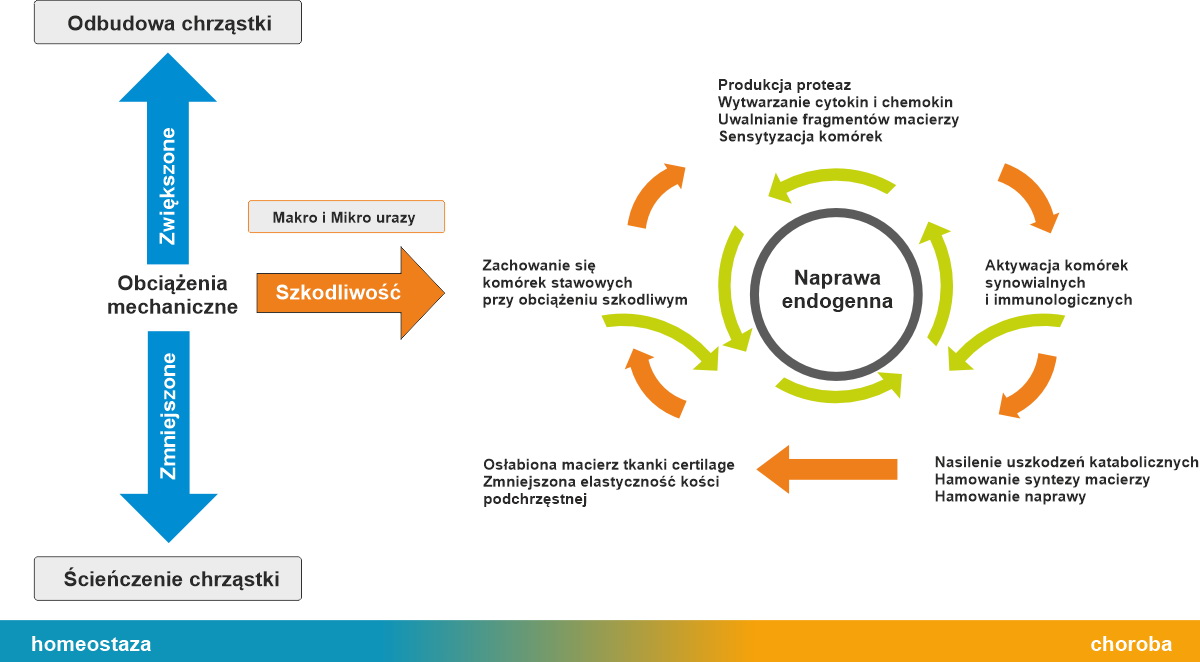
Rysunek 1
Schemat obrazujący zaburzenie równowagi pomiędzy odbudową, a niszczeniem chrząstki w chorobie zwyrodnieniowej stawu.
Uszkodzenie chrząstki jest dominującym elementem w przebiegu choroby zwyrodnieniowej stawów. U podłoża wcześniejszego zużywania się chrząstki leży proces zapalny o niepoznanej do końca etiologii4,5. Proces zapalny toczy się na poziomie komórkowym i prowadzi do degeneracji białek macierzy chrząstki stawowej (kolagen, proteoglikany), przyczyniając się do jej rozmiękania i niszczenia. Bezpośrednio odpowiedzialne są za to niszczące enzymy proteolityczne, tak zwane metaloproteinazy (ang matrix metalloproteinases, MMP). Są one produkowane przez komórki chrząstki – chondrocyty. Obecnie znanych jest ponad 20 enzymów z tej grupy. W normalnych, fizjologicznych warunkach, enzymy MMP są unieszkodliwiane (- czynione nieczynnymi) przez inhibitory metaloproteinaz (ang. tissue inhibitors of metalalloproteinasses, TIMP).
W zdrowym stawie istnieje równowaga pomiędzy enzymami niszczącymi chrząstkę MMP, a enzymami chroniącymi chrząstkę TIMP. Gwarantuje to utrzymanie stałej grubości chrząstki i stwarza warunki do jej przebudowy (z ang. remodelingu), który dostosowuje chrząstkę do zmieniających się warunków mechanicznych.
W chorobie zwyrodnieniowej dochodzi do zachwiania równowagi na korzyść enzymów niszczących MMP, co prowadzi do ścieńczenia chrząstki i szeregu niekorzystnych zmian w stawie. Poznanie i zrozumienie kaskady reakcji zapalnej na poziomie molekularnym daje nadzieje na zahamowanie niszczenia stawu. Rysunek 1.
Klasyfikacja uszkodzeń chrząstki
Obecnie najczęściej stosuje się 2 klasyfikacje uszkodzeń chrząstki, które opisują stopnie chondromalacji. Jest to skala wg Outerbridge’a i skala wg ICRS (International Cartilage Repair Society). Zasadniczo są one bardzo podobne – obie opierają się na głębokości uszkodzeń chrzęstnych.
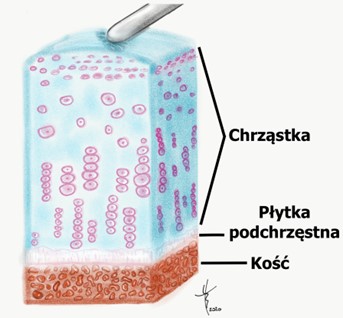
- Stopień I to jedynie rozmiękanie i obrzęk chrząstki, (rysunek 2)
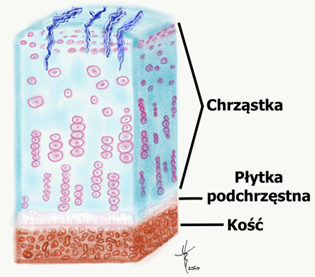
- Stopień II – w chrząstce pojawiają się szczeliny, pęknięcia, które nie są głębsze, niż połowa grubości chrząstki, rysunek 3
- Stopień III – szczeliny sięgają ponad połowę grubości chrząstki, (rysunek 4)
- Stopień IV uszkodzenie są głębokie, sięga aż do warstwy podchrzęstnej kości
W przypadku uszkodzeń chrząstki, nie tylko głębokość ubytku chrząstki ma znaczenie, ale również jej lokalizacja. Najczęstszym miejscem uszkodzeń są strefy obciążane stawu. W przypadku stawu kolanowego mogą one dotyczyć stawu udowo-piszczelowego, bądź rzepkowo-udowego. Zmiany w stawie udowo-piszczelowym, , w szczególności, gdy uszkodzenia dotyczą kłykci kości udowej oferują szersze możliwości leczenia. Ubytki chrząstki na kłykciach piszczeli są trudne do leczenia ze względu na stosunkowo cienką chrząstkę w tym miejscu i trudności w dostępie w technikach artroskopowych. Podobnie ma się sytuacja, gdy zmiany zlokalizowane w okolicy rzepki i bloczku kości udowej (staw rzepkowo-udowy). W dużej mierze ze względu na zmienną topografię tych okolic oraz trudność dostępu chirurgicznego do powierzchni chrzęstnej rzepki.
Postawienie diagnozy
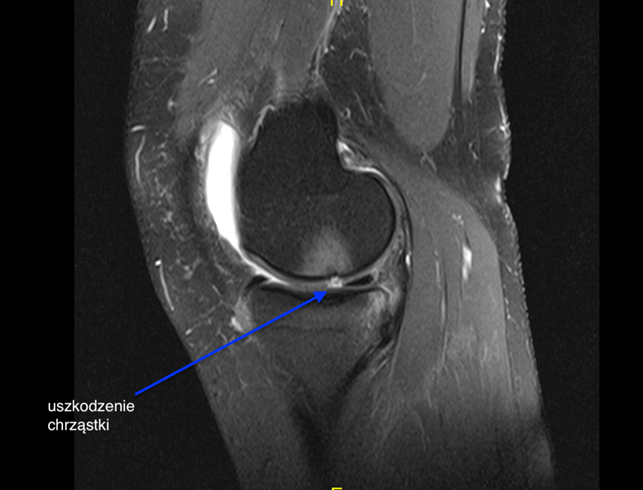
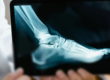
W przypadku każdej choroby, by postawić właściwe rozpoznanie należy pacjenta zbadać. Badanie ortopedyczne nie wystarczy do postawienia trafnej diagnozy, pozwoli natomiast ocenić bolesny staw, zakres jego ruchu, stabilność oraz oś obciążania kończymy. W każdym przypadku podejrzenia uszkodzenia chrząstki należy wykonać klasyczne badanie radiologiczne. To badanie dostarcza lekarzowi wiedzę na temat stawu, ale nie zawsze ujawnia uszkodzenie. Najbardziej czułym i dokładnym badaniem jest badanie rezonansu magnetycznego. Zdjęcie 1.
Leczenie
Taktyka leczenie uszkodzeń chrząstki jest kompleksowe, długotrwałe i zależy od wielu czynników6:
- stopnień uszkodzenia chrząstki (wg Outerbridge’a lub wg ICRS)
- czy uszkodzenie powstało w wyniku urazu we wcześniej zdrowym stawie?
- czy uszkodzenie jest wynikiem przeciążeniowo-zwyrodnieniowego procesu?
- czy uszkodzenie jest ograniczone do jednego miejsca, czy dotyczy większego obszaru stawu?
- wieku chorego
- masy ciała chorego
- oczekiwań pacjenta
Leczenie zachowawcze-nieoperacyjne.
Ten typ leczenia rekomendowany jest u większości przypadków jako próba poprawy, a w szczególności u pacjentów z uszkodzeniami w przebiegu choroby zwyrodnieniowej i umiarkowanymi objawami. Leczenie powinno być kompleksowe i obejmować postępowanie niefarmakologiczne i farmakologiczne. Uważam, że sukces leczenia nieoperacyjnego w dużej mierze zależy od działań niefarmakologicznych, a jest to przede wszystkim modyfikacja stylu życia, na którą składa się:
– edukacja pacjenta – chrząstka nie regeneruje się do stanu sprzed uszkodzenia, ale można uzyskać poprawę, ustąpienie bólu i poprawę jakości życia pacjenta. Nie uda się tego uzyskać bez zaangażowania pacjenta i często modyfikacja czynników zależnych od pacjenta ogranicza konieczność stosowania leczenia farmakologicznego
– masy ciała – temat dość powszechnie poruszany, ale zarazem bardzo wrażliwy, w szczególności u kobiet. Należy zauważyć, że osoby z BMI >27,5 kg/m2 mają o 50,4% większe ryzyko uszkodzeń chrząstki w porównaniu z przy BMI <22,5 kg/m2 , a ryzyko uszkodzenia chrząstki i pojawienia się zmian zwyrodnieniowych wzrasta średnio o 5% na każdy 1 kg/m 2 BMI.7,8
– aktywność ruchowa – pozwala na utrzymanie zakresu ruchów w stawie i odbudowę siły mięśniowej oraz utrzymanie elastyczności tkanek miękkich. Wpływa to na funkcje narządu ruchu i zmniejsza natężenie bólu, również zmniejszenie cytokin zapalanych w płynie stawowym99
Leczenie farmakologiczne
Niestety, jak do tej pory nie ma farmakologicznego rozwiązania czyli preparatu, który „odbudowywałby” chrząstkę. Nawet, jeżeli w reklamach telewizyjnych producenci różnych suplementów chcą nas do tego przekonać. ? W przypadku uszkodzeń chrząstki związanych ze zmianami przeciążeniowo-zwyrodnieniowymi w stawie, znajdują zastosowanie leki niesteroidowe przeciwzapalne, szczególnie w okresach zaostrzeń bólu. Mogą one być stosowane zarówno miejscowo, jak i ogólnoustrojowo (doustnie). Miejscowe stosowane NLPZ są polecane w farmakoterapii bólu przy znacznie mniejszym ryzyku działań niepożądanych, szczególnie z przewodu pokarmowego. Wybór leku oraz jego postaci powinien podlegać indywidualizacji i zależeć od wieku chorego oraz ewentualnych współtowarzyszących chorób. W przypadku choroby zwyrodnieniowej polecane są preparaty nimesulidu, ketopofenu, deksketoprofenu czy dikofenaku. Leki te powinny być stosowane jedynie w momentach zaostrzeń bólu, okresowo nie dłużej niż 10 dni. Szczególna grupą leków to leki z grupy SYSADOA (symptomatic slow acting drugs in osteoarthritis). Do tej grupy należy glukozamina i chondroityna. Związki te są pochodnymi glikozoaminoglikanów, które budują macierz pozakomórkową chrząstki. Uważa się, że ich stosowanie może promować wytwarzanie endogennych glikozoaminoglikanów przez chondrocyty.Zmniejsza on również stan zapalny w stawie, który leży u podłoża niszczenia chrząstki w chorobie zwyrodnieniowej, redukując też dolegliwości bólowe. Efekt stosowania tych preparatów jest zauważalny po kilku tygodniach ich przyjmowania. Główną ideą stosowania SYSADOA jest łagodzenie bólu, poprawa funkcjonalności stawu oraz zmniejszenie konieczności przyjmowania innych leków przeciwbólowych10.
Więcej o tym piszę:
https://biegajacyortopeda.pl/porady-ortopedy/czy-suplementy-na-stawy-naprawde-dzialaja/
Leczenie małoinwazyjne – iniekcje dostawowe.
Aby uzyskać dobry efekt leczenia uszkodzeń chrząstki, pacjentom cierpliwie tłumaczę, że należy połączyć leczenie niefarmakologiczne wynikające ze zmiany stylu życia, diety i aktywności fizycznej z leczeniem farmakologicznym i chirurgicznym. Bardzo często iniekcje dostawowe są jednak pierwszym wyborem w leczeniu, co niekoniecznie jest zgodne z rekomendacją towarzystw naukowych. Wśród preparatów podawanych dostawowo dominują preparaty kwasu hialuronowego i osocza bogatopłytkowego (PRP).
Kwas hialuronowy
Kwas hialuronowy to makrocząsteczka, związek organiczny-polisacharyd, będący naturalnym składnikiem macierzy pozakomórkowej chrząstki. Związek ten posiada specyficzne właściwości biofizyczne, biochemiczne oraz bioregulujące. Podanie do stawu kwasu hialuronowego (wiskosuplementacja) zmniejsza objawy (działa przeciwbólowo) oraz poprawia funkcje stawu. Kwas hialuronowy ma działanie biologiczne, poprzez modulacje procesu zapalnego, który niszczy staw. Hamuje on działanie niszczących enzymów metaloproteinaz MMP. Ma też działanie biofizyczne, gdyż poprawia poślizg powierzchni stawowych, czyli działa podobnie jak „smar” w łożysku. Preparaty kwasu hialuronowego różnią się budową jego cząsteczki, masą cząsteczkową oraz obecnością dodatkowych wiązań pomiędzy nimi (usieciowany kwas hialuronowy), które zapewniają dłuższy efekt działania. Podanie kwasu hialuronowego łagodzi objawy uszkodzenia chrząstki.
Więcej o tym: https://biegajacyortopeda.pl/porady-ortopedy/kwas-hialuronowy-jak-on-dziala/
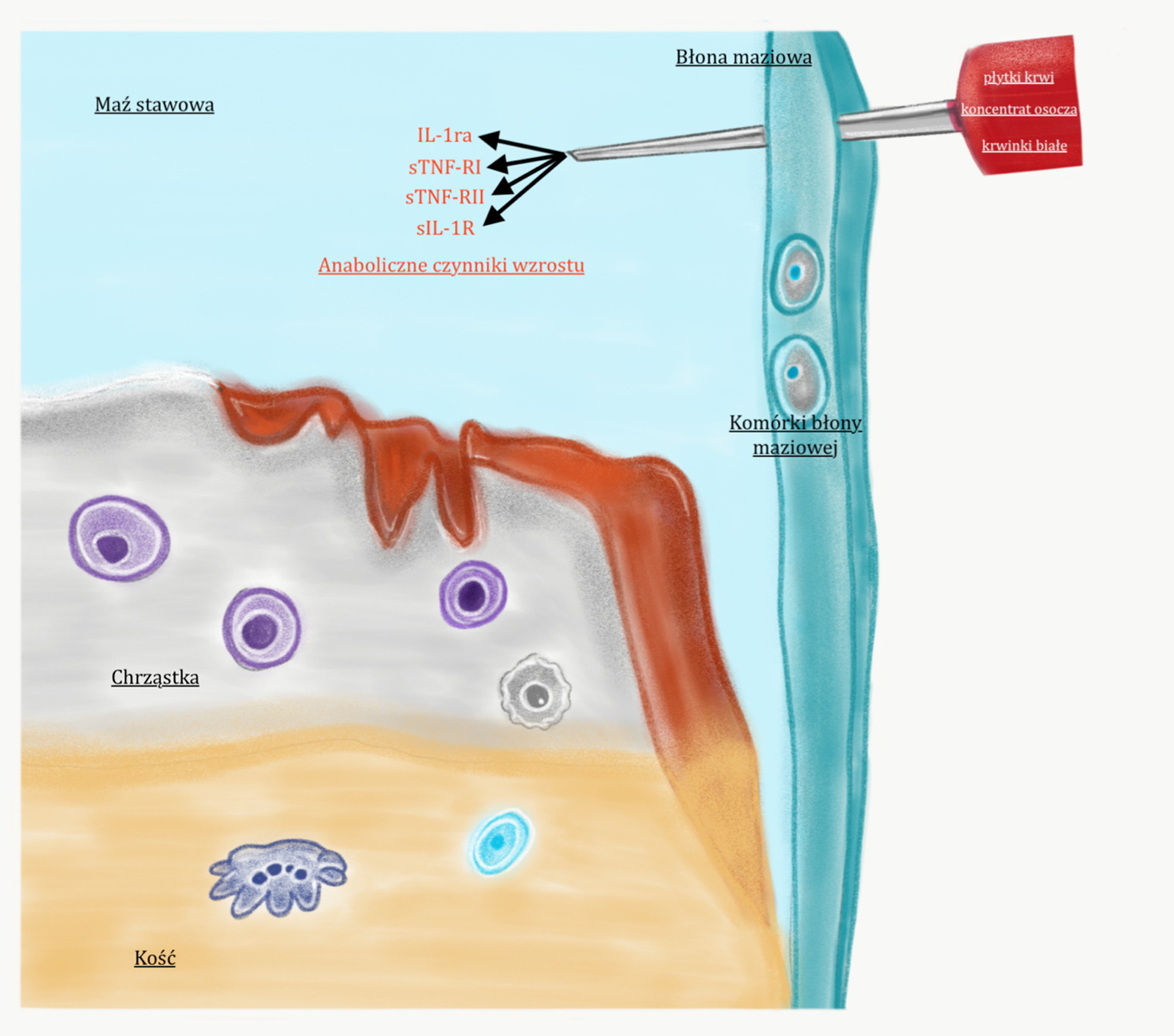
Osocze bogatopłytkowe PRP.
Komórki płytek krwi są naturalnym składnikiem krwi człowieka, a główna ich funkcja, to udział w procesie krzepnięcia. Są one również źródłem cytokin – mediatorów, które hamują destrukcyjny proces zapalny oraz stymulują gojenie. Potocznie nazywane są też czynnikami wzrostu. Należą do nich:
– FGF czynnik wzrostu fibroblastów
– PDGF płytkopochodny czynnik wzrostu
– TGF beta transformujący czynnik wzrostu
– VEGF Czynnik wzrostu śródbłonka naczyniowego
Płytki krwi pozyskuje się poprzez poddanie krwi żylnej pacjenta specjalnej obróbce (odwirowanie i selekcjonowanie). Dzięki temu uzyskuje się osocze z dużą koncentracją płytek krwi (osocze bogatokomórkowe). Zastosowanie osocza bogatokomórkowego (platelet rich plasma PRP) pozwala na ograniczeniu procesu zapalnego toczącego się w stawie oraz aktywuje procesу naprawcze i regeneracyjne. Czynniki wzrostu zawarte w osoczu bogatopłytkowym hamują niszczycielskie działanie metalaoproteinaz-enzymów odpowiadających za niszczenie chrząstki. Rysunek 6.
Więcej o tym https://biegajacyortopeda.pl/porady-ortopedy/komorki-krwi-a-choroba-zwyrodnieniowa-stawow/
https://biegajacyortopeda.pl/porady-ortopedy/wsparcie-dla-stawow/
Rysunek 6.
Podanie osocza bogatopłytkowego wspomaga hamowanie procesu zapalnego oraz aktywuje procesy naprawcze.
Rys. Tomasz Borkowski
Leczenie chirurgiczne.
Wskazania do leczenia chirurgicznego uszkodzeń chrząstki są bardzo indywidualne. Zależą one przede wszystkim od wieku chorego oraz globalnego stanu chrząstki w stawie. Generalnie należy rozważyć operację u pacjentów relatywnie młodych z objawowymi, ogniskowymi uszkodzeniami. Przez słowo ogniskowe, rozumiemy ograniczony ubytek, przy zdrowej pozostałej chrząstce stawu. Leczenie operacyjne należy również rozważyć u pacjentów, u których nie powiodło się leczenie zachowawcze.
Istnieje kilka opcji chirurgicznego leczenia:
1.Artroskopowy „debridment” stosowany w przypadku rozległych uszkodzeń chrząstki w przebiegu choroby zwyrodnieniowej, polega na usunięciu wolnych, niestabilnych uszkodzeń chrząstki, mogący być mechaniczną przeszkodą w ruchu. Dodatkową korzyścią tej procedury jest wyplukanie czynników zapalnych ze stawu. Obecnie pojawiają się głosy krytyczne wobec takiego postępowania, sugerujące, że efekt takiego leczenia jest krótkotrwały, a sam zabieg może stanowić ryzyko dla pacjenta.
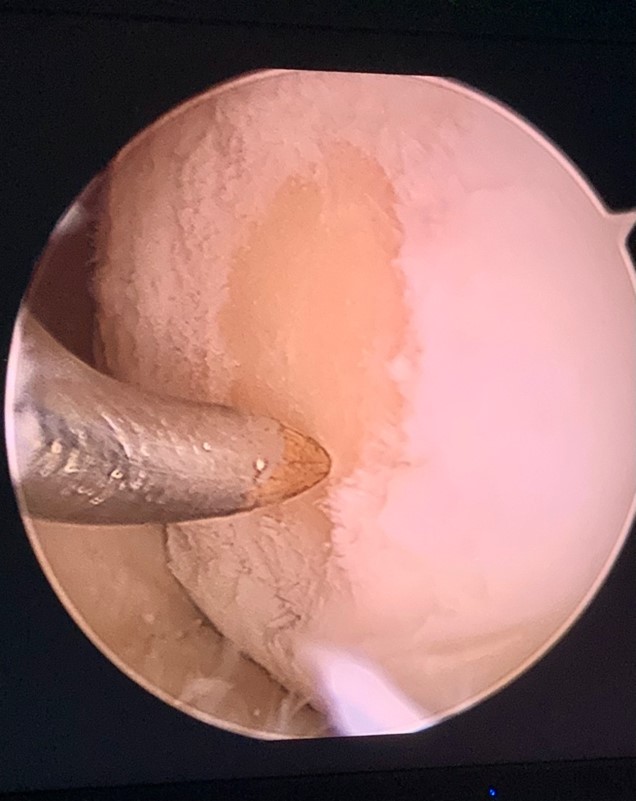
2. Stymulacja szpiku. W szpiku kości znajdują się komórki macierzyste (mesenchymal stem cells MSCs), które mają największy biologiczny potencjał do gojenia uszkodzeń różnych tkanek, w tym chrząstki. Koncepcja stymulacji szpiku, często nazywana „mikrozłamaniem”, została pierwotnie opracowana na początku lat 80 zeszłego stulecia jako metoda leczenia zmian chrzęstnych o pełnej grubości, w celu pokrycia ubytku blizną -chrząstką włóknistą. Technika ta polega na oczyszczeniu uszkodzonej powierzchni chrząstki, aż do warstwy kości. Następnie, przy użyciu specjalnego narzędzia (chondropika), wykonuje się „mikrozłamania” w formie otworów w kości, z których uwalniają się komórki macierzyste szpiku.
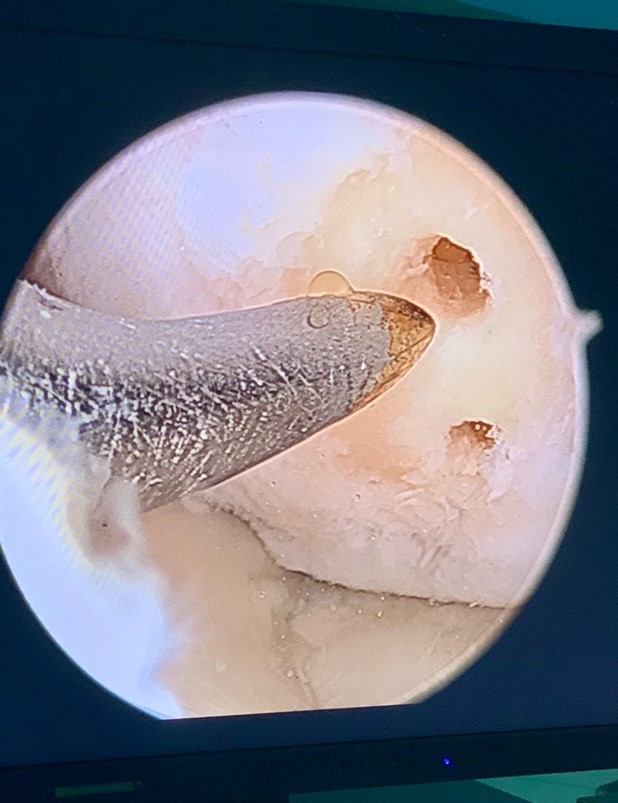
Zdjęcie 2 Komórki te stymulują powstawanie w miejscu ubytku chrząstki włóknistej. Zdjęcie 3.Chrząstka włóknista bardzo przypomina wyglądem chrząstkę szklistą, jednak różnią się właściwościami mechanicznymi i trwałością. Pokrycie ubytku przez chrząstkę włóknistą uwalnia pacjenta od bólu11. Zabieg wykonuje się techniką artroskopową.
Zdjęcie 3.
po wykonaniu mikrozłamań w miejscu uszkodzeniu chrząstki, ubytek pokryty chrząstka włóknistą.
- Membrany kolagenowe.
Aby wzmocnić efekt mikrozłamań, ubytek można pokryć specjalną membraną kolagenową. Miejsce wykonanych mikrozłamań pokrywa się membraną, a procedurę określa się typem „sandwich”. Membrana stanowi rusztowanie, na którym dojdzie do stworzenia blizny. Zabieg ten można, w zależności od lokalizacji, wykonać artroskopowo lub techniką tradycyjną, na „otwarto”.
- Implantację autologicznych chondrocytów (ang. autologous chondrocyte implantation ACI). Implantacja autologicznych chondrocytów (ACI) to kolejna technika stosowana coraz częściej w leczeniu ograniczonych defektów chrzęstnych pełnej grubości. Jest to terapia komórkowa, której celem jest przywrócenie chrząstki szklistej. Obecne techniki ACI wykorzystują macierz powiązaną z implantem, a zatem procedura jest określana jako MACI. Ta technika leczenia uszkodzeń chrząstki składa się z dwóch etapów. W pierwszym pobierane są od pacjenta komórki jego chrząstki szklistej ( z miejsc nieobciążanych stawu). Następnie, w laboratorium, namnaża się się komórki, by w kolejnej operacji wszczepić je w miejsce uszkodzenia. Zaletą tej procedury jest regeneracja własnej tkanki pacjenta oraz fakt, że technika ta może być stosowana w przypadku stosunkowo dużych ubytków lub ubytków wielokrotnych. Dalsze badania wykazały, że chrząstka wytworzona w procedurach ACI jest bardziej podobna do chrząstki szklistej niż chrząstka włóknista wytworzona podczas mikrozłamań12.
- Autoprzeszczep kostno-chrzęstny (OATS osteochondral autograft transfer). Procedura ta, nazywana również plastyką mozaikową, to sposób leczenia, w którym wykonuje się przeszczep własnej chrząstki pacjenta z miejsca nieobciążanego, w miejsce uszkodzenia. W tym celu pobiera się bloczki chrząstki w raz z warstwą podchrzęstną kości (najczęściej bloczki w kształcie walca) i na wcisk mocuje się je w uprzednio przygotowane miejsce. Uważa się, że chondrocyty znajdujące się w przeszczepionej części chrząstki pozostają żywe, a leżąca poniżej kość podchrzęstna wgaja się do kości podchrzęstnej ubytku 13. Tą operacje wykonuje się na „otwarto”.
Leczenie uszkodzeń chrząstki w stawie pozostaje dla ortopedów cały czas wyznaniem. Medycyna nie oferuje jednej, skutecznej metody leczenia. Skala problemu może być bardzo różnorodna – od okresowych pobolewań do stałego bólu ograniczającego funkcjonowanie.
Niestety, uszkodzenia chrząstki bywały już przyczyną klęski wielu sportowych planów. Na szczęście, pojawiają się coraz nowsze, biologiczne sposoby leczenia i dzięki temu wiele marzeń udaje się jednak zrealizować ?.
Bibliografia.
- Carballo CB, Nakagawa Y, Sekiya I, Rodeo SA. Basic Science of Articular Cartilage. Clin Sports Med. 2017;36(3):413-425. doi:10.1016/J.CSM.2017.02.001
- Visser NA, de Koning MHMT, Lammi MJ, Häkkinen T, Tammi M, van Kampen GPJ. Increase of decorin content in articular cartilage following running. Connect Tissue Res. 1998;37(3-4):295-302. doi:10.3109/03008209809002446
- Miller RH. Joint Loading in Runners Does Not Initiate Knee Osteoarthritis. Exerc Sport Sci Rev. 2017;45(2):87-95. doi:10.1249/JES.0000000000000105
- Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthritis Cartilage. 2013;21(1):16-21. doi:10.1016/j.joca.2012.11.012
- Madry H, Luyten FP, Facchini A. Biological aspects of early osteoarthritis. Knee Surgery, Sports Traumatology, Arthroscopy 2011 20:3. 2011;20(3):407-422. doi:10.1007/S00167-011-1705-8
- Bekkers JEJ, Inklaar M, Saris DBF. Treatment Selection in Articular Cartilage Lesions of the Knee: A Systematic Review. American Journal of Sports Medicine. 2009;37(1_suppl):148S-155S. doi:10.1177/0363546509351143
- Guh DP, Zhang W, Bansback N, Amarsi Z, Birmingham CL, Anis AH. The incidence of co-morbidities related to obesity and overweight: A systematic review and meta-analysis. BMC Public Health. 2009;9. doi:10.1186/1471-2458-9-88
- Messier SP, Resnik AE, Beavers DP, et al. Intentional Weight Loss in Overweight and Obese Patients With Knee Osteoarthritis: Is More Better? Arthritis Care Res (Hoboken). 2018;70(11):1569-1575. doi:10.1002/ACR.23608
- Halilaj E, Hastie TJ, Gold GE, Delp SL. Physical activity is associated with changes in knee cartilage microstructure. Osteoarthritis Cartilage. 2018;26(6):770-774. doi:10.1016/J.JOCA.2018.03.009
- Bruyère O, Honvo G, Veronese N, et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. 2019;49(3):337-350. doi:10.1016/j.semarthrit.2019.04.008
- Weber AE, Locker PH, Mayer EN, et al. Clinical Outcomes After Microfracture of the Knee: Midterm Follow-up. Orthop J Sports Med. 2018;6(2). doi:10.1177/2325967117753572/ASSET/IMAGES/LARGE/10.1177_2325967117753572-FIG2.JPEG
- Grawe B, Burge A, Nguyen J, et al. Cartilage Regeneration in Full-Thickness Patellar Chondral Defects Treated with Particulated Juvenile Articular Allograft Cartilage: An MRI Analysis. Cartilage. 2017;8(4):374-383. doi:10.1177/1947603517710308
- Epstein D, Choung E, Ashraf I, … DG… J of A, 2012 undefined. Comparison of mini-open versus arthroscopic harvesting of osteochondral autografts in the knee: a cadaveric study. Elsevier. Accessed September 14, 2022. https://www.sciencedirect.com/science/article/pii/S0749806312015836
Jeśli podoba Ci się to, co publikuję, udostępnij post na Facebooku – pomóż mi szerzyć wiedzę